- HOME>
- ポータブルガスモニター>
- ホルムアルデヒド測定器>
- 電気化学的燃料電池とは
電気化学的燃料電池とは
歴史と概要
燃料電池の概念は新しいものではありません。これの起源はウィリアム・グローブ卿が1839年に行った 一連の実験にまでさかのぼることができます。 彼の実験装置(図1)は、2つの白金電極を硫酸の電解液に浸し、電圧計を介して電気的に接続したものでした。 ひとつの電極に水素ガスが供給され、もうひとつの電極に酸素ガスが供給されて、約1ボルトの回路電圧が生じるというものでした。
あいにくこの「電解質ガス電池」から得られる電流は小さすぎて、実用的な電気エネルギー供給源としては有効に機能できませんでした。
グローブの電池の動作方式は単純で、水素が陽極で酸化され、電解質中で溶媒が中和されます。
H2 → 2H+ + 2e-
2H+ + 2H2O → 2H3O+
イオン化段階で発生する電子は外の回路を介して陰極に運ばれ、ここで次の式により還元されます。
1/2O2 + H2O + 2e- → 2OH-
続いて水素イオンはヒドロキシルイオンと結合して水になります。
H3O+ + OH- → 2H2O
グローブの電池は、このようにして水素と酸素が供給される限り電気エネルギーを生産しました。しかし反応中に生成する水のために電解液が徐々に薄まるため、出力は徐々に減少しました。
19世紀の終わりから、発電に適した燃料電池を開発する目的でさかんに研究が行われました。
あいにく実用上多くの問題と電池材料の高いコストが重なって、このようなシステムの実現可能性は、宇宙探査のようなコストが二の次になるような場合を除き、急激に低下しました。
しかしながら今日、環境問題の高まりから燃料電池の開発は内燃機関に代わり次世代自動車の動力源として脚光を浴び始めました。各国、各自動車会社の熾烈な開発競争は、始まったばかりです。
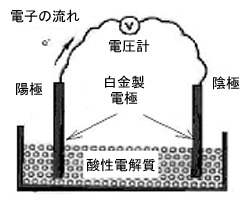
図1.ウィリアム・グローブ実験装置
分析センサーとしての燃料電池
当初、燃料電池は特に気体や蒸気用の分析センサーとして燃料電池より有望な用途となりました。燃料電池は2つの電極をもち、プロセス全体の中でどちらも消費されず、外部の電源から電圧を印加されません。このため、現在、市販されている定電位電解式のセンサーやポーラログラフ式センサーとは測定原理が違います。
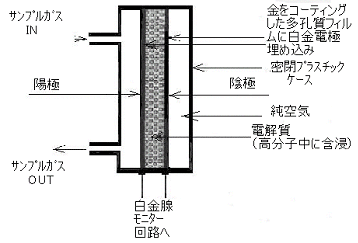
分析燃料電池の動作の一般原理は単純で、図2に示すとおりです。
サンプルガスを動作電極側に導入し、この時、結果として生ずる電気出力が、サンプルガス中の特定の化学物質の濃度に比例する事を利用します。絶対必要な条件はそのサンプルガス中の被測定化学物質が必ず酸化性ガスか還元性ガスのいずれかであるということです。
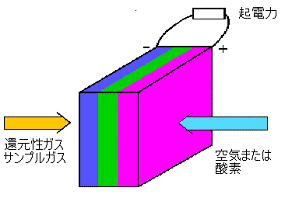
燃料電池を分析検知器に使用することの利点は、次のようなものです。
- 検知限界値が低いため、多量のサンプルを必要としない電池の反応によって電池のどの部分も消費されず永久変性を受けないため
- 有効寿命が長い
- 測定ガスの選択性が高いため一般にサンプルの前処理が不要
- ガス濃度と出力が直線関係にあるので測定器として出力信号処理等が容易でコンパクトな構造を取りやすくポータブル測定器として最適である
これらの燃料電池の特徴から一般に分析装置は小型になり全体のデザインも単純になりました。
ホルムアルデメータについて
以上の様な原理をアルコール類とアルデヒド類の定量測定のためにさらに改良を加えられ製作された測定器が「ホルムアルデメータ」です。もともとガスクロマトグラフィーによる分離を組み合せたアルコール類とアルデヒド類の測定のためにグルーバーとハックが開発したセンサーがもとになっています。英国カージフでの広範な研究の結果相当な改良が加えられ、直線的な反応特性を得るために設計された独自の吸引システムとともに用いられる燃料電池式センサーが作られました。